Направленный транспорт лекарственных средств и лечебные физические факторы
Одной из актуальных проблем современной медицины и фармакологии является низкая селективность лекарственных средств. Вводимые в организм традиционными способами лекарства распределяются в нем относительно равномерно, проникая в различные органы и ткани [1, 2]. Согласно имеющимся сведениям [3], лишь 1% введенной дозы попадает в клетки-мишени. В силу этого лекарственное вещество достигает своих биологических мишеней в концентрации, значительно меньшей по сравнению с необходимой терапевтической, что вынуждает использовать дозы, которые превышают теоретически необходимые. Остальное количество препарата, поступившего в нецелевые органы и ткани, нередко вызывает побочные реакции.
Более перспективным подходом к решению этой проблемы является создание систем направленного транспорта лекарств [4-7]. Реализация целенаправленного концентрирования лекарственных препаратов преимущественно в зоне патологического очага позволяет резко снизить нежелательные реакции организма на медикаментозное воздействие, уменьшить терапевтическую дозировку лекарства и кратность его введения.
Лекарства, снабженные системой доставки, имеют ряд преимуществ по сравнению со свободными препаратами: повышается растворимость гидрофобных лекарств; улучшается их проникновение в клетки; улучшается фармакокинетика; у лекарств появляется способность преодолевать мембранные и гематоэнцефалический барьеры; пролонгируется действие лекарственных средств; обеспечивается необходимая биосовместимость и защита от преждевременной деградации; осуществляются направленный транспорт и контролируемое высвобождение лекарств и др. [7, 8].
Обзору современных транспортных систем лекарственных средств и роли в них лечебных физических факторов посвящена настоящая статья.
Сегодня можно говорить о нескольких направлениях, обеспечивающих различной степени избирательность доставки лекарств к целевой области. Наиболее простым и доступным является регионарное (местное) введение фармакологических препаратов. К этому направлению могут быть отнесены следующие методы (способы):
– внутрисуставное введение лекарственных веществ при заболеваниях опорно-двигательного аппарата;
– введение противоопухолевых препаратов в сосуд, питающий опухоль;
– внутрикоронарное введение тромболитических ферментов при терапии вызванного тромбозом инфаркта миокарда;
– введение цитостатиков в ложе опухоли во время операции при внутримозговых опухолях;
– ингаляции лекарств при бронхолегочных заболеваниях;
– спинномозговые блокады при патологии позвоночника с болевым синдромом;
– введение в полость гнойника растворов противомикробных средств, ферментов и других препаратов;
– применение лекарств в глаз (в конъюнктивальный мешок) в офтальмологии;
– нанесение на кожу лекарственных препаратов в виде мазей, пластырей, примочек при кожных заболеваниях;
– субдуральное и субарахноидальное введение лекарств при заболеваниях центральной нервной системы и др. [1, 2, 5].
Как показывают многочисленные клинические наблюдения, применение местного введения лекарственных средств эффективнее их системного использования. Однако данный подход не всегда оказывается достаточно эффективным и применим далеко не при всех заболеваниях.
Расширению возможностей этого направления и повышению эффективности его методов способствует применение некоторых физиотерапевтических факторов. Здесь прежде всего следует назвать внутритканевой электрофорез. Суть метода состоит в том, что лекарственное вещество вводится в организм одним из общепринятых способов, а затем проводится поперечное воздействие постоянным непрерывным током на ту область тела, где необходимо максимально локализовать действие препарата [9, 10]. Электрофорез по глазнично-затылочной и назальной методикам способствует направленному введению лекарств в мозг [10, 11]. В ряде наших исследований показано, что предварительное воздействие некоторыми физическими факторами (ультразвук, магнитное поле, микроволны, лазерное излучение, тепловые воздействия) способствует усиленному поступлению лекарств в ткани зоны применения физиотерапевтической процедуры [12]. Повышение локальной концентрации лекарственных веществ отмечается также при проведении ультрафонофореза, магнитофонофореза и лазерофореза [10, 11].
Для направленного транспорта лекарств пытаются использовать конъюгацию с молекулами (векторами), обладающими тропностью к определенным тканям, клеткам или субклеточным структурам. Конъюгация лекарственного препарата с вектором, например белком, осуществляется с помощью химической сшивки, в простейшем случае за счет дисульфидной или тиоэфирной связи либо путем применения полиэтиленгликолевого или пептидного линкера [5]. Этот подход наиболее активно исследуют в онкологии. Так конъюгат α-фетопротеина, обладающего сродством к поверхности раковых клеток, с цитотоксическими антибиотиками (доксорубицин, карминомицин) позволил существенно увеличить их онкоцидную активность в эксперименте на мышах с перевивными опухолями [13]. Были также созданы и изучены конъюгаты α-фетопротеина с фталоцианинами, хлоринами, винкристином и винбластином, продемонстрировано значительное увеличение их цитотоксической активности в отношении различных линий опухолевых клеток [14]. Трансферрин в качестве вектора использован в отношении как противоопухолевых антибиотиков (доксорубицин, даунорубицин), так и белкового токсина – рицина [15]. Для доставки лекарств к опухолевым клеткам молочной железы, яичников и предстательной железы, имеющим на своей поверхности повышенное количество LHRH-рецепторов, предложено использовать пептидный гормон гонадолиберин [16]. Положительные результаты получены также при использовании конъюгатов эпидермального фактора роста и его рецепторсвязывающего фермента с противоопухолевыми препаратами [14, 17-19]. В качестве альтернативного подхода могут быть рассмотрены результаты разработки препаратов направленного действия в виде конъюгатов α-фетопротеина с антисмысловыми олигонуклеотидами (АСОН) к мРНК генов, играющих ключевую роль в регуляции клеточной пролиферации и апоптоза. Экспериментальные исследования по использованию АСОН для ингибирования трансляции мРНК генов, гиперэкспрессия которых приводит к опухолевой трансформации, продемонстрировали их высокую специфичность в отношении своих мишеней [20, 21].
В качестве векторов изучают применение моноклональных антител (МКА) к различным рецепторам на поверхности клеток, прежде всего раковых (трансферриновые рецепторы, рецепторы фактора роста эпителия, СД-рецепторы и др. [22, 23]. МКА чаще используются для векторизации не собственно лекарственных веществ, а различных наночастиц, транспортирующих лекарства.
Из многих способов направленного транспорта лекарственных средств наиболее реальным на данный момент представляется использование в качестве транспортного средства форменных элементов крови. Методы, основанные на использовании клеток крови для модификации их свойств с целью создания внутриклеточного депо препарата и осуществления направленного транспорта, объединены под общим названием «экстракорпоральная фармакотерапия». Клетки крови, нагруженные лекарственным веществом, обозначают термином «фармакоциты». В качестве фармакоцитов используют эритроциты, лейкоциты и тромбоциты, обладающие различными транспортным потенциалом и тропностью. Эти системы доставки лекарств наиболее выгодны с точки зрения их биологической совместимости [24].
С позиции экстракорпоральной фармакотерапии предпочтение отдается использованию в адресном транспорте лекарств эритроцитов – наиболее многочисленных клеток крови с рядом значимых морфологических, физико-химических и физиологических характеристик. Можно указать на следующие их достоинства как переносчиков лекарственных средств: высокая степень биологической совместимости, особенно при использовании аутологичных клеток; длительность циркуляции в кровотоке, значительно превышающая аналогичные показатели для искусственных транспортеров; способность к биологической гибели и как следствие отсутствие токсичных для организма продуктов деградации; возможность переноса широкого спектра фармакологических препаратов; относительно инертная внутриклеточная среда, защищающая транспортируемое лекарство от инактивации эндогенными факторами; простота получения из крови в достаточном для транспорта терапевтической дозы лекарства количестве [25].
Терапевтический эффект лекарственного вещества, заключенного в эритроцит, реализуется благодаря захвату и лизированию последнего преимущественно макрофагами селезенки и печени, созданию в этих органах высоких локальных концентраций препарата [24]. Как правило, эритроциты с минимальным уровнем повреждений разрушаются селезенкой, а значительно поврежденные – печенью [26]. С помощью эритроцитов обеспечивается транспорт лекарственных веществ и в ткани легких [27].
Включение лекарственных препаратов в эритроциты осуществляется различными способами, среди которых самым распространенным является гипоосмотический метод. При его использовании эритроциты помещают в солевой раствор с пониженной ионной силой, в котором у них образуются поры, через которые подлежащие включению вещества проникают внутрь клетки [25, 26]. Для загрузки лекарственных препаратов в эритроциты могут использоваться физические факторы, а также химические агенты, являющиеся индукторами эндоцитоза [5].
Высвобождение фармакологических препаратов из эритроцитарных носителей также осуществляется различными путями: простая диффузия, активный транспорт и разрушение клеточных носителей [24, 26].
Для иллюстрации приведем несколько работ, в которых эритроциты использовались как система для направленного транспорта лекарственных средств. В одной из них сообщается о применении антигипоксантов и ингибиторов протеолиза в эритроцитарных контейнерах при комплексной терапии гепаторенального синдрома, способствовавшем в 1,5-2,0 раза более быстрому купированию проявлений гепато- и нефропатий по сравнению с традиционным лечением заболевания [28]. Для коррекции иммунитета предложено использовать связывание эритроцитами тимических пептидов и глюкокортикоидных гормонов [29]. В онкогематологии предложено применять эритроциты для переноса L-аспарагиназы, которая при введении в кровь вызывает гибель аспарагинзависимых лейкозных клеток [26]. Такие препараты как андромицин, блеомицин, метотрексат, введенные в строму эритроцитов, хорошо себя зарекомендовали при лечении опухолей печени [5]. Обосновано применение направленного транспорта канамицина в «тенях» эритроцита для лечения гнойно-воспалительных заболеваний желчных путей и показана его большая эффективность по сравнению с традиционным внутривенным введением препарата [30].
Другим направлением в экстракорпоральной фармакотерапии является использование аутолейкоцитов, получаемых методом цитофереза. Действие лейкоцитарных носителей осуществляется таким образом: после насыщения лекарственными веществами и возврата в кровеносное русло лейкоциты за счет хемотаксиса мигрируют преимущественно в очаг воспаления, где путем стимулированного экзоцитоза или после своего разрушения высвобождают лекарственный препарат [31]. В одной из работ показано, что применение направленного транспорта антибиотиков в аутологичных лейкоцитах при лечении больных острыми воспалительными заболеваниями почек позволяет значительно уменьшить частоту гнойно-септических осложнений, сократить длительность пребывания в стационаре [32]. Успешно использованы лейкоциты в качестве естественного носителя цефтазидима при лечении пациентов с тяжелыми формами пневмонии. Применение этого метода сопровождалось достоверным снижением сроков госпитализации, летальности, а также урежением развития пневмоний [33]. Делаются успешные попытки использовать для направленного транспорта антибиотиков аутогенной клеточной массы крови, получаемой в ходе плазмофереза [31, 34].
Проводится изучение использования тромбоцитов в качестве контейнеров-переносчиков лекарственных средств. В частности, этот подход с успехом применен при лечении пациентов с облитерирующим заболеванием нижних конечностей [5]. Этот выбор основывался на том, что кровяные пластинки обладают повышенной тропностью к эндотелию, поврежденному атеросклеротическим процессом.
А.А. Тепловым [35] предложено использовать для направленного транспорта биологически активных веществ и лекарственных препаратов стволовые клетки, получаемые из костного мозга, периферической и пуповинной крови или жировой ткани. Им показано, что частицы фторуглеродной эмульсии, содержащей биологически активные вещества (инсулин, фактор некроза опухоли, ронлейкин, антибиотики, ацикловир и др.) проникают внутрь стволовых клеток. Согласно исследованиям на мышах со спонтанным раком молочной железы, более 30% вводимых стволовых клеток накапливалось в опухолевой ткани. Опыты с авастином показали, что высвобождаемый из стволовых клеток препарат оказывает специфическое терапевтическое действие. Учитывая сложную биологию стволовых клеток, их использование для направленного транспорта лекарственных веществ требует дальнейшего изучения.
В качестве транспортного средства в медицине и ветеринарии, прежде всего в генной терапии, предлагается использовать вирусные частицы. Вирусные частицы – это белковые структуры, основанные на вирусных капсидах, размеры которых лежат в нанометровом диапазоне. Они могут представлять собой непосредственно вирусные частицы, содержащие молекулы нуклеиновой кислоты и являющиеся способными к инфицированию, либо вирусоподобные частицы, представляющие собой только белковый вирусный капсид, не несущие нуклеиновой кислоты и являющиеся не способными к инфицированию [36].
Применение наночастиц на основе вирусов (ВНЧ) имеет ряд существенных особенностей по сравнению с другими транспортными носителями:
1. Вирусные частицы каждого определенного вируса обладают регулярной структурой и характеризуются одинаковыми размерами, а свойства поверхности многих вирусов хорошо изучены или могут быть исследованы доступными средствами.
2. Поверхность вирусного капсида является поливалентной, т.е. содержит множество сайтов, доступных для модификации.
3. ВНЧ в высокой степени стабильны и устойчивы ко многим физическим и химическим воздействиям.
4. ВНЧ являются природными наноматериалами, что делает их биоразлагаемыми и биосовместимыми.
5. В случае ВНЧ легко вносить изменения в белки капсида путем модификации генетического материала.
6. Доступны методы получения значительных количеств ВНЧ в течение короткого времени с невысокими финансовыми затратами [36].
В настоящее время ВНЧ исследуются в качестве носителей для вакцинных препаратов и мультифункциональных систем для терапии, главным образом, онкологических заболеваний, позволяющих осуществлять направленную доставку лекарственных препаратов, средств визуализации и фотодинамической терапии, контрастирующих агентов для магнитно-резонансных исследований и др. [36-38].
Наряду с несомненными достоинствами вирусные векторы имеют ряд существенных недостатков. Так, ретровирусные системы способны активизировать онкогены и блокировать опухолевые супрессорные гены в инфицированных клетках [39], а аденовирусные системы – продуцировать токсичные вирусные белки и вызывать сильную иммунную реакцию [40].
Широкие возможности и большие перспективы сулит использование для адресной доставки лекарств различных искусственных наноструктур (липосомы, мицеллы, микросферы, дендримеры, фуллерены, полимерные наночастицы и др.).
Прежде всего следует упомянуть о липосомах как контейнерах для транспорта лекарственных средств, так как пока только липосомальные препараты дошли до клинических испытаний и ряд из них лицензирован [3, 7, 41-43]. Липосомы представляют собой концентрические пузырьки, стенки которых образованы двухслойной липидной мембраной, состоящей преимущественно из природных фосфолипидов. Они нетоксичны, биодеградируемы, обеспечивают защиту заключенных в них веществ и их постепенное высвобождение, при определенных условиях поглощаются клетками, их мембрана может сливаться с клеточной мембраной, что приводит к внутриклеточной доставке содержимого липосом [43]. Липосомы могут служить в качестве переносчиков как для гидрофильных, так и для гидрофобных веществ. Лекарственное вещество может находиться либо во внутреннем пространстве липосомы, если оно водорастворимо, либо в липидной оболочке, если оно жирорастворимо.
Липосомы сегодня используются в качестве носителей для противораковых, противотуберкулезных и противогрибковых препаратов, а также для доставки вакцин [44-46]. Липосомы, сформированные катионными липидами, применяются для доставки терапевтических средств на основе нуклеиновых кислот (антисмысловые олигонуклеотиды, аптамеры, векторы для генной терапии и др.) [36, 47]. Липосомальные препараты эффективны как при пассивном нацеливании, так и, особенно, при активном нацеливании. Для активного нацеливания на поверхности везикул находится направленный вектор (антитело, лиганд рецептора и др.).
Недостатками липосом как носителей лекарств являются их низкая стабильность, низкая эффективность инкапсуляции лекарственного вещества и высокая себестоимость [36].
Среди альтернативных липосомам систем наибольший интерес, по-видимому, вызывают полимерные наночастицы. Они представляют собой твердые частицы размером от 1 до 1000 нм, состоящие из полимеров как природного (альбумин, хитозан, альгинат), так и синтетического (полилактиды, полиакрилаты и др.) происхождения. Транспортируемые лекарственные вещества могут быть инкапсулированы, адсорбированы или присоединены ковалентной связью [3, 4]. Помимо высокой стабильности и емкости к достоинствам полимерных наночастиц следует отнести их способность связывать как гидрофобные, так и гидрофильные вещества, а также пригодность их для введения в организм различными способами, в том числе пероральным и ингаляционным [4].
При введении в организм лекарства высвобождаются из полимерных наночастиц путем диффузии и/или десорбции. Выделению их также способствует набухание полимерной матрицы, ее эрозия и деградация. Поскольку скорость деградации полимеров, используемых для получения наночастиц, варьирует в довольно широких пределах (от часов до нескольких месяцев), то применение полимерных наночастиц в качестве транспортных систем позволяет контролировать выделение активного ингредиента.
Попадая в кровоток, полимерные наночастицы быстро адсорбируют белки плазмы (опсонизация). Опсонизированные наночастицы распознаются системой мононуклеарных фагоцитов, которые выполняют функцию очистки крови от посторонних частиц. Захват наночастиц макрофагами (печени, селезенки, костного мозга) происходит путем эндоцитоза, после чего они попадают в лизосомы, где происходит их разрушение и высвобождение лекарственных веществ.
Для «снижения» узнаваемости наночастиц макрофагами и удлинения времени их нахождения в кровотоке поверхность наночастиц подвергают стерической стабилизации, создающей так называемый стелс-эффект (от англ. stealth – невидимый). Чаще всего для этой цели используют поверхностно-активные вещества. Теоретические и технологические принципы, лежащие в основе создания наночастиц типа «стелс», изложены в обзоре S. Moghimi и соавт. [48].
Наиболее значительная часть работ, посвященных исследованиям полимерных наночастиц в качестве систем доставки лекарств, относится к химиотерапии злокачественных новообразований. Результаты этих исследований обобщены в ряде обзоров [4, 14, 41, 49]. Используются они и для транспорта противотуберкулезных препаратов (рифампицин, изониазид, пиразинамид, стрептомицин и др.), эффективность которых доказана in vitro и in vivo [44]. Направленный транспорт лекарств с использованием полимерных наночастиц апробируется и в других областях клинической медицины [3, 4, 50, 51].
Наряду с пассивной доставкой лекарств, которая происходит в результате естественного биораспределения носителя и зависит от его физико-химических свойств и состояния мишени, полимерные наночастицы могут применяться и для активного транспорта фармакологических препаратов. Активный транспорт достигается за счет специфического взаимодействия лиганда (вектора) на поверхности наночастиц с соответствующими рецепторами, находящимися на поверхности клетки-мишени. В качестве векторов для полимерных наночастиц используют аполипопротеины, трансферрин, фолаты, интегрины и др. [3, 36, 42].
Для целевой доставки лекарств, биологически активных соединений и контрастирующих веществ используют и другие типы наночастиц [36, 42, 46, 48, 50, 52]:
а) мицеллы, представляющие собой амфифильные коллоидные структуры, образующиеся в водных растворах спонтанно из мономеров и заданных молекул лекарственного вещества при определенных условиях; используются в качестве носителей некоторых лекарств и контрастирующих агентов для визуализации;
б) дендримеры, в особенности фуллереновые дендримеры, являющиеся полимерами, обладающими четко упорядоченной симметричной деревообразной структурой, представляющей собой регулярные ветвления, исходящие из центрального ядра; предложено их использование в качестве носителей молекул ДНК, антивирусных соединений, вакцин и противоопухолевых препаратов;
в) аквасомы, которые представляют собой наночастицы, центральная часть которых представлена неорганическим керамическим ядром, покрытым снаружи оболочкой, состоящей из сахаров либо других полигидроксильных олигомеров, создающих квазиводную среду; их применяют для доставки веществ белковой природы и вакцин;
г) наночастицы на основе неорганических веществ и металлов, прежде всего оксидов железа, золота, серебра и др.; находят применение, в частности, наносферы, образованные металлом-диэлектриком (например, покрытые золотом кварцевые наносферы); наносферы предложены в качестве носителей для инсулина при лечении диабета, противоопухолевых средств и др.
Для направленного транспорта лекарств апробируют также и такие типы наночастиц, как углеродные нанотрубки, ниосомы, твердые липидные наночастицы, магнитные наночастицы.
Отдельного упоминания заслуживают модульные нанотраспортеры (МНТ), предназначенные прежде всего для доставки лекарств непосредственно внутрь клетки. МНТ являются рекомбинантными полипептидами, функциональные модули которых обеспечивают: 1) избирательное узнавание клетки-мишени с последующим эндоцитозом за счет лигандного модуля; 2) выход из эндосом в цитоплазму за счет эндосомолитического модуля; 3) транспорт в ядро за счет модуля с последовательностью ядерной локализации; 4) эффективное присоединение доставляемого лекарства, обеспечиваемое модулем-носителем [53].
На культуре клетки меланомы показано, что фотосенсибилизатор, конъюгированный с МНТ, на два порядка эффективнее по сравнению со свободным фотосенсибилизатором [54]. На животных с различными типами привитой меланомы установлено, что МНТ высокоизбирательно накапливается в опухоли и обеспечивает до 93% задержки ее роста и достоверное увеличение продолжительности жизни животных, пролеченных фотосенсибилизатором, конъюгированным с МНТ, по сравнению с пролеченными свободным фотосенсибилизатором [53]. Высокая эффективность этого метода продемонстрирована также при лечении мышей с привитой эпидермоидной карциномой человека. Было выявлено 98% ингибирование роста опухоли при доставке хлорина е6 с помощью МНТ. Все нелеченые животные умерли к 24-му дню после прививки опухоли, тогда как после лечения фотосенсибилизатором, доставленным МНТ, 75% мышей-опухоленосителей выжили (в контроле, где применялась обычная методика фотодинамической терапии, выжили лишь 20% животных) [55]. Перспективность использования МНТ в фармакотерапии не вызывает сомнения, но их внедрение в практическую медицину требует еще продолжения исследований на других патологических моделях с применением различных компонентов модулей.
Таким образом, сегодня по многим направлениям ведется активный поиск средств для направленной доставки лекарств различных фармакотерапевтических групп, прежде всего для химиотерапии опухолей и инфекционных заболеваний. Некоторые из предложенных транспортных систем уже доведены до клинического использования. Однако огромное разнообразие биологических мишеней и фармакологических задач неизбежно будет требовать совершенствования известных и разработки новых систем доставки лекарств. Для повышения эффективности транспортных систем и устранения их нежелательных эффектов могут использоваться различные химические и физические воздействия.
Как уже упоминалось, лечебные физические факторы могут самостоятельно использоваться для целевой доставки лекарств в определенные органы и ткани, а также для модификации естественного распределения лекарств, вводимых в организм общепринятыми способами. Наряду с этим, как нам представляется, они должны найти применение и для совершенствования различных систем направленного транспорта лекарств. О нескольких направлениях такого использования физических факторов можно говорить уже сегодня.
Прежде всего, по-видимому, речь должна идти о магнитных наночастицах, в использовании которых важная роль принадлежит физическим факторам, прежде всего магнитному полю. Материалом для получения этих наночастиц служат оксиды железа (Fe3O4 или γ-Fe2O3). Магнитные наночастицы имеют размеры от 15 до 75 нм и при их стабилизации сохраняются в течение 2-5 лет [56]. Основными преимуществами магнитных наночастиц является то, что они могут быть: визуализированы (при магнитно-резонансной томографии); направлены и удержаны в определенном месте с помощью внешнего магнитного поля; нагреты для инициации высвобождения переносимых ими лекарственных веществ [57].
Для транспорта лекарственных веществ магнитные наночастицы могут быть использованы самостоятельно или включены в состав других видов нанотранспортеров. Наиболее перспективным на данный момент считается использование с этой целью липосом, нагруженных магнитными наночастицами (магнитолипосомы) и лекарственными веществами. Магнитолипосомы обеспечивают стабильность магнитных наночастиц, возможность покрытия их поверхности специфическими лигандами (векторами) и защиту инкапсулированного в них лекарственного вещества [58]. В онкологии магнитные частицы могут быть дополнительно использованы для проведения магнитной гипертермии, что может быть положено в основу сочетанного метода противоопухолевой терапии [59]. С этой же целью могут быть использованы золотые наночастицы, для нагрева которых или высвобождения из них транспортируемых лекарственных веществ можно применить лазерное излучение инфракрасного диапазона [60].
Магнитные частицы, или магнитолипосомы, нагруженные лекарственным средством, избирательно накапливаются в опухоли или другой целевой зоне под действием внешнего магнитного поля, сфокусированного на нужной области. Многие исследования подтвердили принципиальную возможность адресной доставки наночастиц с магнитными свойствами в определенные органы и ткани [61-63]. В частности, значительное накопление наночастиц в опухоли почки и внутренних органах кролика зафиксировано через 60 мин после внутриартериального введения раствора наночастиц и применения источника внешнего магнитного поля [64]. На экспериментальной модели остеосаркомы морских свинок продемонстрировано максимальное накопление наночастиц в ткани опухоли под действием магнитного поля через 60 мин после введения раствора магнитных наночастиц в яремную вену [65]. Ряд других исследований также свидетельствуют об эффективности управляемой доставки лекарств с помощью магнитных наночастиц и внешнего магнитного поля [66-68].
В последние годы для фотодинамической терапии начинают использовать фотосенсибилизаторы, доставляемые в опухоли или другие пролиферирующие ткани с помощью наночастиц [59]. Фотодинамический эффект при этом наблюдался при меньших интенсивностях лазерного излучения, чем при традиционных способах применения фотосенсибилизаторов [53-55]. В онкологии весьма перспективным может оказаться применение в качестве носителя фотосенсибилизатора фуллеренов, которые при фотооблучении генерируют синглетный кислород и проявляют противоопухолевое действие [8, 69]. Генератором синглетного кислорода являются и наночастицы пористого кремния [70].
Физические факторы могут использоваться и для улучшения инкапсулирования (связывания, адсорбции) лекарственных веществ системами направленного транспорта. Например, предварительное экспонирование эритроцитов и лейкоцитов в ультрафиолетовых лучах или магнитном поле усиливает иммуномодулирующую, гепатопротекторную и антиоксидантную активность полученных из них эритроцитарных и лейкоцитарных носителей с включенными антибиотиками (ампициллин, цефазолин) [71]. Для быстрейшего и большего включения в эритроциты фармакологических препаратов используется электропорация, осуществляемая путем помещения эритроцитов и лекарственного вещества в пульсирующее электрическое поле напряженностью до 20 кВ/см [5]. Превышение трансмембранного потенциала приводит к временному образованию пор в клеточной мембране, что существенно облегчает поступление лекарств в эритроцит [5]. Для повышения фиксации антибактериальных препаратов транспортными клеточными системами используют облучение их гелий-неоновым лазером длиной волны 633 нм [32].
В направленной доставке лекарственных веществ важным этапом является высвобождение их из транспортирующей системы. Для этого применяют различные способы, в том числе и воздействие лечебными физическими факторами. В работах J. West и соавт. [72, 73] описаны системы доставки лекарств на основе нанокапсул, покрытых диэлектрическим материалом (кремний, золото), высвобождение препарата из которых происходит после расплавления капсул под воздействием облучения. Показана возможность использования для лечения диабета нанокапсул с инсулином, чувствительных к инфракрасному облучению. Дозированное высвобождение инсулина происходит при нагревании кожи в месте введения наносфер [74]. Кварцевые капсулы с ферромагнитными частицами внутри, имеющие векторы к клеткам опухоли, концентрируются в них и активируются под воздействием импульсного магнитного поля при достижении опухолевых тканей [69, 75]. Активация таких нанотранспортных систем может происходить и при воздействии электрическими полями, рентгеновскими лучами или светом [75].
Для увеличения поступления наночастиц с лекарствами в ткани с низкой проницаемостью, а также для преодоления гистогематических барьеров также используют физические факторы – ультразвук, лазерное излучение, инфракрасные лучи [76]. Исследователи Калифорнийского университета в Сан-Диего (США) создали полимер, который разрушается под действием света (740 нм) и освобождает переносимые им лекарственные вещества.
Известны термочувствительные липосомы, состоящие из фосфолипидов с температурой фазового перехода выше, чем температура тела [77]. Например, препарат ThermoDax, применяемый в комплексе с нагревом токами высокой частоты, проходит клинические испытания при рецидивирующем раке молочной железы [78]. В РОНЦ им. Н.Н. Блохина РАН разработана лиофилизированная термочувствительная липосомальная лекарственная форма доксорубицина с размером частиц 170±20 нм и эффективностью инкапсулирования препарата в везикулы 87-94% [41]. В доклинических испытаниях, проведенных на меланоме В16 и солидной карциноме Эрлиха, показано, что термолипосомальный доксорубицин в комбинации с локальной гипертермией (43 °С) обладает большей избирательностью действия по сравнению со свободным доксорубицином [41, 79]. Предложены также фоточувствительные липосомы, которые высвобождают содержащиеся в них лекарственные средства при воздействии ультрафиолетовыми лучами [80].
Будет уместным подчеркнуть, что в последние годы и в различных странах значительно повысился интерес к использованию лечебных физических факторов в нанотехнологиях, включая и направленный транспорт лекарственных веществ.
Интенсивные исследования, проведенные в последнее десятилетие, позволили разработать многочисленные подходы к адресной доставке лекарственных веществ – от местного введения препаратов до их химической модификации и заключения в капсулы и оболочки. Среди них наибольшую известность получили транспортные системы, основанные на использовании наночастиц естественного и искусственного происхождения (липосомы, полимерные наночастицы, вирусные частицы, модульные нанотраспортеры и др.). Многие из них имеют хорошие клинические перспективы, прежде всего, снабженные специфическими векторами. Ряд транспортных систем чувствителен к действию физических факторов (магнитные поля, свет, ультразвук и др.), что открывает перспективы для использования последних на различных этапах направленного транспорта фармакологических препаратов. Необходимы дальнейшие целенаправленные исследования с участием различных специалистов, в том числе и физиотерапевтов, для создания новых и совершенствования разработанных транспортных систем лекарств, что откроет новые горизонты фармакотерапии не только онкологических, но и других распространенных заболеваний.
Обезьянья оспа – причины появления, симптомы заболевания, диагностика и способы лечения
Обезьянья оспа: причины появления, симптомы, диагностика и способы лечения.
Определение
Оспа обезьян — редкое вирусное зоонозное заболевание, то есть передающееся человеку от животных. Вирус оспы обезьян является родственником натуральной («черной») оспы, относится к тому же к роду ортопоксвироусов (Orthopoxvirus), но отличается более легким течением болезни и сравнительно низкой смертностью. Вероятность тяжелого течения выше у детей, беременных женщин и людей с угнетенным иммунитетом.
 Вирус обезьяньей оспы впервые обнаружили у лабораторных обезьян в Дании, где заболели макаки-крабоеды из Сингапура, содержавшиеся вместе с макаками-резусами, – отсюда появилось и название «оспа обезьян».
Вирус обезьяньей оспы впервые обнаружили у лабораторных обезьян в Дании, где заболели макаки-крабоеды из Сингапура, содержавшиеся вместе с макаками-резусами, – отсюда появилось и название «оспа обезьян».
Первый случай заболевания среди людей был зарегистрирован в 1970 году в Республике Конго. Эндемичными («родными») для этого вируса являются страны Африки.
Первая вспышка за пределами Африки случилась в Соединенных Штатах в 2003 году. В страну привезли примерно 800 экзотических животных из Ганы, среди которых оказались хомячковые крысы, зараженные этим вирусом, от них заразились луговые собачки, которых в Техасе продавали как домашних питомцев.
Европа столкнулась с этим заболеванием в 2023 году, когда в Великобритании было зарегистрировано 7 случаев обезьяньей оспы у людей, вернувшиеся из экзотических стран.
Последние сообщения о новых заражениях в разных странах мира обезьяньей оспой появились в мае 2023. И хотя пока зарегистрировано чуть более сотни подтвержденных случаев и чуть меньшее количество людей – с подозрением на обезьянью оспу, ВОЗ заговорила о новой пандемии и необходимости вакцинации населения.
В этот раз болезнь распространяется необычно: большинство заразившихся в Африку не ездили. Нет и явной цепочки заражений — случаи оспы обезьян фиксируются в разных частях света, хотя больше всего их в Европе. По количеству случаев заболевания сейчас лидируют Португалия, Испания, Великобритания. Случаи обезьяньей оспы зафиксированы в Австралии, Бельгии, Канаде, Франции, Израиле, Германии, Италии, Нидерландах, Швеции, США. Появились сообщения о заболевших в Швейцарии и Греции. В конце мая количество стран за пределами Африки, в которых выявлены случаи заболевания, выросло до 17.
Случаев заражения жителей России на момент написания статьи, по данным Роспотребнадзора, не зарегистрировано.
Причины появления обезьяньей оспы
Оспа обезьян передается людям от мелких грызунов (белок, крыс, мышей) и приматов через укусы и прямой контакт с животным. Считается, что вирус-возбудитель обезьяньей оспы имеет умеренную трансмиссивность (способность к инфицированию) среди людей. Передача вируса от человека к человеку требует очень тесного контакта с уже заболевшим. В большинстве случаев заражение происходит воздушно-капельным путем, через биологические жидкости (сперму, слюну, кровь), а также контакт с зараженными материалами (постельным бельем, одеждой), если нарушена целостность кожного покрова. Высоким считается риск передачи во время полового акта, и низким – во всех остальных случаях.
По одной из версий, быстрое распространение оспы обезьян в последнее время может быть вызвано новым штаммом, приспособленным для передачи от человека к человеку. Другой причиной может быть ослабление иммунитета к натуральной оспе.
Считается, что резкое увеличение заболеваемости связано с прекращением всеобщей вакцинации против обычной оспы в 1980 году. Вспышку заболевания могло вызвать и возобновление туризма после карантина по COVID-19.
Существует еще одна версия: ведущий советник Всемирной организации здравоохранения назвал беспрецедентную вспышку обезьяньей оспы в развитых странах «случайным событием», которое, по-видимому, было вызвано сексуальной активностью на двух недавних массовых мероприятиях в Европе. Косвенно эту версию поддерживает тот факт, что большинство случаев в Европе зафиксировали у гомо- и бисексуальных молодых мужчин в возрасте от 21 до 40 лет. Среди них преобладают участники майского гей-парада Гран-Канария на Канарских островах, в котором приняли участие около 80 000 человек из разных стран Европы, и посетители знаменитой гей-сауны под Мадридом. Несколько случаев заражения оспой обезьян были выявлены в Бельгии после проведения ЛГБТ крупномасштабного фестиваля в Антверпене.
Таким образом, вариант глобальной эпидемии обезьяньей оспы, такой как COVID-19, пока маловероятен, считают эксперты Европейского центра профилактики и контроля заболеваний.
Во-первых, оспа обезьян не очень заразна: показатель R0 (число людей, которых может заразить один носитель) для нее составляет от единицы до двойки. Для сравнения, у омикрон-варианта коронавируса показатель R0 мог достигать 12.
Во-вторых, вирус плохо передается воздушно-капельным путем. Большинство случаев связано с половыми контактами и соприкосновением с биологическими жидкостями. В отличие от коронавируса, оспа обезьян не образует аэрозолей (мелких капель, которые создают воздушную взвесь и могут преодолевать большие расстояния). Кроме того, обезьянья оспа не является болезнью, которая передается во время бессимптомной фазы, что, кстати, делало COVID-19 таким грозным заболеванием.
В-третьих, даже при мутации вируса от него уже есть испытанная вакцина, которую можно при необходимости доработать. А новые варианты вируса обезьяньей оспы не могут появляться так быстро, как у COVID-19, в силу биологии самого вируса.
Однако следует иметь в виду, что вирус может в какой-то момент мутировать таким образом, что начнет эффективно передаваться от человека к человеку. Именно такая вероятность вызывает самые большие опасения.
Классификация заболевания
По данным ВОЗ, выделяются две основные ветки штаммов:
- Западноафриканский (считается более легким, коэффициент смертности 3,6% от заболевших);
- Центральноафриканский («конголезский»), считается более тяжелым, летальность 10,6%.
Симптомы обезьяньей оспы
Инкубационный период оспы обезьян обычно составляет от 6 до 16 дней, редко может достигать 21 дня.
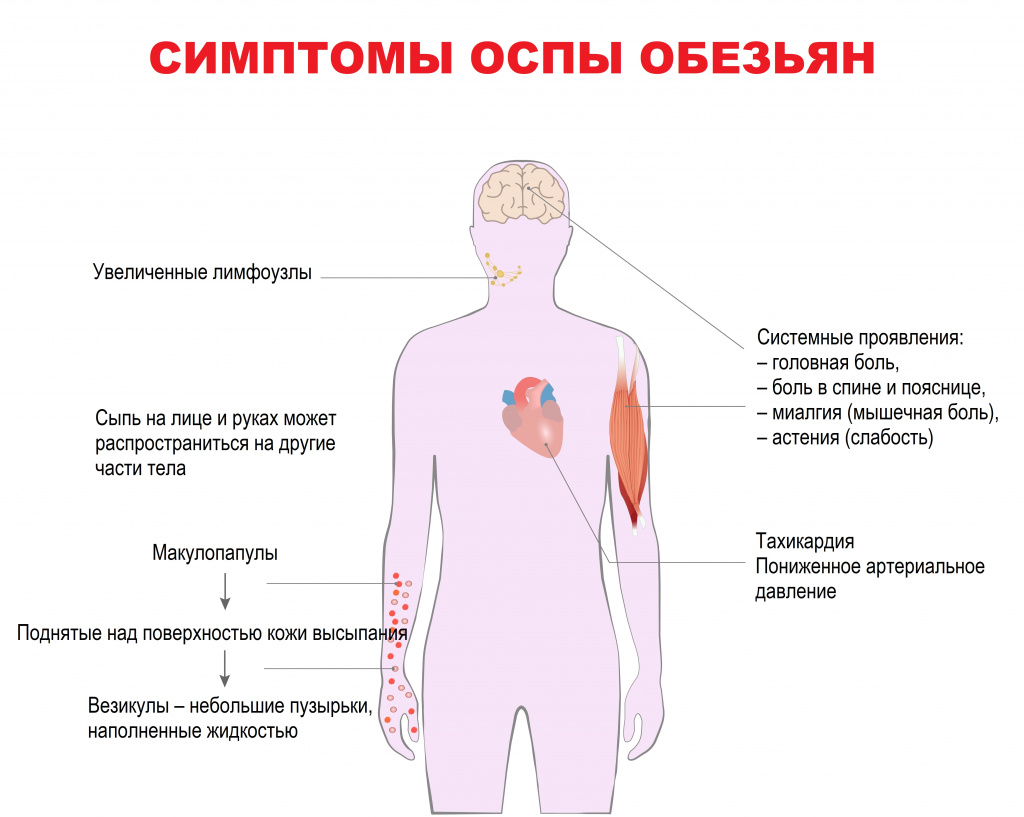
Период инвазии (0-5 дней), для которого характерны лихорадочное состояние с повышением температуры выше 38,5°C, сильная головная боль, боль в спине и пояснице, миалгия (мышечная боль) и сильная астения (слабость).
У некоторых пациентов развивается тяжелая лимфаденопатия (увеличение/воспаление лимфатических узлов), которая является отличительным признаком оспы обезьян.
Период высыпаний на коже (через 1-3 дня после возникновения лихорадки)
, которые вначале манифестируют на лице (в 95% случаев), а также на ладонях и ступнях (в 75% случаев), затем распространяются на другие части тела. Высыпания проходят несколько этапов развития – от макулопапул (поражений кожи с плоским основанием) до везикул (небольших наполненных жидкостью пузырьков) и пустул, которые примерно через 10 дней покрываются корочками. До полного исчезновения корочек может пройти три недели.
Больные часто сообщают о гриппоподобных симптомах с поражением органов дыхания. Сами высыпания часто описываются как очень болезненные независимо от того, где они локализуются.
Сыпь, связанную с обезьяньей оспой, можно спутать с проявлениями других заболеваний, встречающихся в клинической практике (например, вторичным сифилисом, герпесом, шанкроидом и ветряной оспой, опоясывающим лишаем).
Диагностика обезьяньей оспы
Клиническая дифференциация оспы обезьян от оспы и ветрянки (вызванной вирусом герпеса, а не поксвирусом), может быть затруднена. Диагноз оспы обезьян устанавливают с помощью бакпосева, метода полимеразной цепной реакции (ПЦР), иммуногистохимии или электронной микроскопии.
Для исключения ветряной оспы и опоясывающего лишая используют следующие лабораторные тесты:
- анализ крови на выявление антител IgG;
В российском научном центре «Вектор» сообщили о создании тестов для выявления возможных случаев заражения оспой обезьян, которые можно будет применять во внелабораторных условиях, то есть «у постели больного».
К каким врачам обращаться
Людям, у которых могут быть симптомы обезьяньей оспы, следует обратиться к
врачу-терапевту, врачу общей практики или врачу-инфекционисту. Детей принимает
врач-педиатр.
В группу риска входят все, кто:
- путешествовали в страны Центральной или Западной Африки, части Европы, где были зарегистрированы случаи оспы обезьян, или другие районы с подтвержденными случаями оспы обезьян в течение месяца до появления симптомов,
- был в контакте с человеком с подтвержденной или подозреваемой обезьяньей оспой.
Лечение обезьяньей оспы
Специфические виды лечения или вакцины от оспы обезьян отсутствуют, однако вспышки этого заболевания поддаются контролю.
Оспа обезьян обычно является самоизлечивающимся заболеванием, симптомы которого сохраняются от 14 до 21 дня.
Тяжелые случаи заболевания чаще всего происходят среди детей и связаны со степенью воздействия вируса, состоянием иммунной системы пациента и тяжестью осложнений.
В США с 2023 года одобрен противовирусный препарат бринцидофовир для лечения оспы, а в 2023 году Европейская медицинская ассоциация одобрила противовирусное средство, известное как тековиримат. Его разрешено применять в Европе в случае вспышки заболевания. Все эти препараты обладают активностью против обезьяньей оспы in vitro и в экспериментальных моделях. Тем не менее, ни один из них не был до конца изучен или использован в эндемичных районах для лечения больных оспой обезьян.
В остальном лечение является поддерживающим и направлено на облегчение симптомов. Пациентам восполняют дефицит жидкости в организме, обеспечивают поступление питательных веществ и устраняют вторичные бактериальные инфекции.
Осложнения
Осложнения оспы обезьян могут включать вторичные инфекции, бронхопневмонию, сепсис, энцефалит и инфекцию роговицы (часто с потерей зрения).
С 1970 по 1990 годы было зафиксировано 47 случаев смертей – все они приходились на детей младше десяти лет. В последние годы на сотню больных приходилось в среднем от трех до шести смертей. В ходе нынешней вспышки пока ни одной смерти не зафиксировано.
Профилактика обезьяньей оспы
Вакцинация против натуральной оспы эффективна против оспы обезьян на 85%. Правда, ее давно не проводят, потому что натуральная оспа считается побежденной. По этой причине люди моложе 40−50 лет могут быть более восприимчивы к обезьянней оспе, чем те, кто когда-то был привит от натуральной оспы.
Пока ВОЗ не рекомендовала возобновить массовую вакцинацию, мотивируя это тем, что, возможно, вакцины потребуют обновления либо вспышка пройдет сама.
Хотя вакцинация от оспы — очень простая процедура: на предплечье наносится несколько царапин, в которые втирается препарат. На этом месте образуется небольшой гнойник, он быстро проходит, и человек получает устойчивость ко всем вирусам оспы. Вакцинироваться от оспы самостоятельно, по личной инициативе, вряд ли получится, поскольку сейчас такая прививка не включена в схемы иммунопрофилактики в России. Гематологический научный центр «Вектор» сообщил, что сейчас прививку от натуральной оспы ставят только медикам, поскольку риск завоза в страну обезьяньей оспы оценивается как крайне низкий.
Как сообщили в Роспотребнадзоре, чтобы не заболеть оспой обезьян, россиянам во время поездок в страны, где она распространена, необходимо избегать контакта с животными, которые могут оказаться носителями вируса, в особенности с грызунами и приматами. Особую бдительность следует проявлять тем, кто прибыл в Демократическую Республику Конго, Камерун, Центральноафриканскую Республику, Нигерию, Кот-д’Ивуар, Либерию, Сьерра-Леоне, Габон и Южный Судан.
Контактируя с людьми, прибывшими из стран, где зафиксированы случаи заболевания, и ощущающими недомогание, необходимо следовать базовым профилактическим правилам — пользоваться маской и соблюдать гигиену рук.
Источники:
- Боровикова З.В. Оспа и вакцинация: исторический аспект // Вестник общественных и гуманитарных наук. 2023;2(4):19-23.
- Борисевич С.В., Логинова С.Я., Кротков В.Т., Терентьев А.И. Оспа обезьян. Научный обзор // Журнал для непрерывного медицинского образования врачей. Инфекционные болезни: новости, мнения, обучение. – 2023. – № 1ю – С. 59-65.
- Grant R., at al. Modelling human-to-human transmission of monkeypox. Bull World Health Organ 2020;98: 638–640.
- О ситуации по оспе обезьян в Российской Федерации. Роспотребнадзор. 24.05.2023.
Характеристики авиамодели my twin dream
Если вы хотите остаться в бюджетном варианте – смотрите на камеру Eachine DVR03, обзор рядом с прошлой камерой тут.
Эта камера пишет на microSD одновременно с передачей видео, таким образом у вас будет и видео на земле и полетное видео.
Второй вариант – это использование более качественной камеры и видеошлема с матрицей на большее количество пикселей.
RunCam Micro Swift 600TVL CCD Camera в комплекте с видеопередатчиком мне еще только едет на обзор, но в интернете достаточно отзывов о ней, что бы считать ее достаточно качественной для FPV полетов.
После получения и написанию обзора я добавлю сюда ссылку и видео.
Небольшие размеры и отдельный видеопередатчик позволяют разместить камеру практически на любой авиамодели или квадрокоптере.
В пару к нему рекомендую видеошлем Eachine VR D2 Pro, обзор тут.
Этот видеошлем прославился отличным DVR рекордером, позволяющим вести запись вашего FPV полета на microSD карту.
Посмотрите видео записанное с полетной камеры квадрокоптера.
Стоит отметить, что камера на квадрокоптере стоит штатная, с весьма средним, можно даже сказать слабым качеством видео. Со Swift качество картинки будет лучше.
Так же в этом варианте стоит установить и отдельную экшен камеру для записи полетного видео прямо на авиамодели, на этом видео не будет эфирных помех, да и качество записи на порядок выше – стоит писать в формате 1920х1080 при 60 кадров в секунду.
RunCam 3, обзор здесь. И RunCam 2, обзор тут.
Для авиамоделей рекомендую вторую версию, она более аэродинамична.
Кстати, RunCam`ы славятся минимальной задержкой при передачи FPV сигнала, так что их можно использовать и как курсовую камеру.
В этом случае отпадет необходимость в курсовой камере, но, потребуется видеопередатчик. Его можно брать любой на 5.8 ГГц с мощностью 200-400 мВт, несколько ссылок на такие видеопередатчики вы найдете в конце статьи.
Предложенные решения не являются “идеальным выбором”, но, они помогут определится вам с имеющимся в продаже FPV оборудованием.
Многие любители полетов Drone Racing переходят на видеоочки, они менее габаритны, “визуальный экран” имеет меньший размер и полностью помещается в поле зрения, но я наоборот перешел на видеошлемы.
И подход тут такой – зачем смотреть широкоформатный фильм на экране мобильного телефона, когда его можно запустить на настенной плазме? Для хорошего полета нужна и хорошая, большая, а не мелкая картинка.
В любом случае, недорогой видеошлем со скидкой за использование всегда легко продать или оставить для резервного использования. К примеру, VR-007 Pro я даю заказчикам во время съемки с квадрокоптера, так же беру на случай если с основным что либо случится и можно было бы продолжить полеты.
Что бы закончить тему видеошлемов посмотрите видео сравния.
Если вас заинтересовало и желаете подробностей с характеристиками и прочим – смотрите статью Сравнение видеошлемов EV800D, VR D2 Pro и VR-007 Pro.
Naza Lite – это оптимальный полетный контроллер для новичка. Его можно перепрошить под полноценную версию DJI Naza V2.
Этот полетник легко настроить: Настройка Naza . Но эта версия не умеет летать по заданным точкам, зато при потере сигнала, ваш дрон не упадет, а вернется в точку взлета.
AMP (Ardupilot Mega) – весьма продвинутый вариант полетного контроллера, требует вдумчивой настройки. Вариант не дешевый, но при должном усердии или умении это весьма продвинутый вариант!
Если установить модуль телеметрии – то данные о полете можно получать на смартфон или планшет и задавать полет по точкам в реальном времени полета.
Также AMP вернет дрон к месту взлета при потере сигнала.
Omnibus позволяет подключить GPS и компас и после установки iNav у вас появится возможность полета по точкам и автовозврата.
Это самый дешевый вариант автопилота с GPS и авторежимами! К тому же настройка Omnibus проще, чем APM.



