- 2 Основные виды химической связи
- Водородная связь
- Вопросы для самопроверки
- Ионы. ионная связь
- Ковалентная химическая связь, ее разновидности и механизмы образования. характеристика ковалентной связи (полярность и энергия связи). ионная связь. металлическая связь. водородная связь
- Кристаллические решетки
- Металлическая связь
- Молекулярное и немолекулярное строение веществ
- Направленность ковалентной связи
- Насыщаемость ковалентной связи
- Характеристики ковалентной связи
2 Основные виды химической связи
Взаимодействие валентных (наименее прочно связанных с ядром) электронов атомов приводит к образованию химических связей, т. е. к объединению атомов в молекулу. Образование молекулы из атомов возможно лишь тогда, когда оно приводит к выигрышу энергии; молекулярное состояние должно обладать меньшей энергией, чем атомное состояние, и, следовательно, быть устойчивее. Таким наиболее устойчивым является состояние атома, когда число электронов на внешнем электронном уровне максимальное, которое он может вместить; такой уровень называется завершенным и характеризуется наибольшей прочностью. Таковы электронные конфигурации атомов благородных газов. Значит, образование химической связи должно приводить к завершению внешнего электронного уровня атомов.
Это взаимодействие валентных электронов, приводящее к образованию химической связи, может осуществляться по-разному. Различают три основных вида химической связи: ковалентную, ионную и металлическую.
Рассмотрим механизм возникновения ковалентной связи на примере образования молекулы водорода (рис. 3):
`”H” “H” = “H”_2`; `Delta”H”=-436` кДж/моль
Реакция сопровождается высвобождением большого количества тепла, значит, она энергетически выгодна.
Ядро свободного атома водорода окружено сферически симметричным электронным облаком, образованным `1s`-электроном. При сближении атомов до определенного расстояния происходит частичное перекрывание их электронных облаков (орбиталей).
Обычно наибольшее перекрывание электронных облаков осуществляется вдоль линии, соединяющей ядра двух атомов.
Ковалентная связь, которая образуется при перекрывании орбиталей вдоль линии, связывающей центры соединяющихся атомов, называется `sigma`-связью.
В каждом атоме хлора `7` валентных электронов, из них `6` в виде неподеленных пар, а `1` – неспаренный электрон. Образование химической связи происходит именно за счёт неспаренных электронов каждого атома хлора. Они связываются в общую пару (или неподелённую пару) электронов. Если считать, что общая пара принадлежит обоим атомам, то каждый из них становится обладателем `8` электронов, т. е. приобретает устойчивую конфигурацию благородного газа. Поэтому ясно, что молекула хлора энергетически выгоднее, чем отдельные атомы.
неподелённые пары остаются при своих атомах, а та что их связывает уже становится поделённой между двумя атомными центрами.
Это также `sigma`-связь, но она образована перекрыванием `p`-электронных орбиталей по оси `x` (рис. 4).
Если в реагирующих атомах имеется $$ 2$$ или $$ 3$$ неспаренных электрона, то могут образоваться не $$ 1$$, а $$ 2$$ или $$ 3$$ связи, т. е. общие электронные пары. Если между атомами возникла одна ковалентная связь, то она называется одинарной, если две -двойной, если три – тройной. Они обозначаются соответственно «`=`» или «`-=`» штрихами.
Но хотя обозначение их одинаково, они отличаются по своим свойствам от одинарной `sigma`-связи. Чтобы пояснить разницу, рассмотрим образование тройной связи в молекуле азота `”N”_2`. В ней атомы имеют три общие пары электронов:
$$ :underset{·}{overset{·}{mathrm{N}}}· ·underset{·}{overset{·}{mathrm{N}}}:to stackrel{··}{mathrm{N}}⋮⋮stackrel{··}{mathrm{N}}$$
Они образованы неспаренными `p`-электронами двух атомов азота:
Орбитали `2p`-электронов расположены взаимно перпендикулярно, т. е. по осям `x`, `y` и `z`. Если перекрывание по оси `x` ведёт к образованию `σ`-связи (перекрывание вдоль линии, связывающей центры атомов), то перекрывание по осям `y` и `z` происходит по обе стороны от линии, связывающей центры соединяющихся атомов. Такая ковалентная связь, возникающая при перекрывании орбиталей по обе стороны от линии, связывающей центры соединяющихся атомов, называется `pi`-связью.
Очевидно, что взаимное перекрывание орбиталей в случае `pi`-связи меньше, чем в случае `sigma`-связи, поэтому `pi`-связь всегда менее прочная, чем `sigma`-связь. Но в сумме три связи `(sigma_x pi_y pi_z)` придают молекуле $$ {mathrm{N}}_{2}$$ большую прочность (рис. 5), поэтому молекула азота при нормальных условиях нереакционноспособна.
Таким образом, если имеется ординарная связь, то это обязательно `sigma`-связь; если имеется двойная или тройная связь, то одна из составляющих её связей обязательно `sigma`-связь (как более прочная она формируется первая и разрушается последняя), а остальные -`pi`-связи. И `sigma`-, и `pi`-связи – это разновидности ковалентной связи.
В общем случае ковалентной называется химическая связь, осуществляемая электронными парами.
Различают неполярную и полярную ковалентную связь. Все рассмотренные выше молекулы образованы атомами одного и того же элемента, при этом двухэлектронное облако связи распределяется в пространстве симметрично относительно ядер обоих атомов, и электронная пара в одинаковой мере принадлежит обоим атомам. Такая связь называется неполярной ковалентной связью.
Иной случай реализуется, если связь образуют два атома различных элементов с отличающимися величинами относительной электроотрицательно-сти, например $$ mathrm{HCl}$$, $$ {mathrm{H}}_{2}mathrm{O}$$, $$ {mathrm{H}}_{2}mathrm{S}$$, $$ {mathrm{NH}}_{3}$$ и др. В этом случае электронное облако связи смещено к атому с большей относительной электроотрицательностью. Такой вид связи называется полярной ковалентной связью.
Например, полярная ковалентная связь образуется при взаимодействии атомов водорода и хлора (рис. 6).
$$ mathrm{H}· ·underset{··}{overset{··}{mathrm{Cl}}}:to mathrm{H}:underset{··}{overset{··}{mathrm{Cl}}}:$$
Электронная пара смещена к атому хлора, так как относительная электроотрицательность хлора `(x=3)` больше, чем у водорода `(x=2,1)`.
У молекул, содержащих неполярную связь, связующее облако распределяется симметрично между ядрами обоих атомов, и ядра в равной степени тянут его к себе. Электрический момент диполя таких молекул $$( {mathrm{H}}_{2},{mathrm{F}}_{2},{mathrm{Cl}}_{2}$$ и др.`)` равен нулю. Молекулы, содержащие полярную связь, образованы связующим электронным облаком, смещенным в сторону атома с большей относительной электроотрицательностью.
Описанные выше примеры образования ковалентной связи относятся к обменному механизму, когда каждый из соединяющихся в молекулу атомов предоставляет по электрону. Однако образование ковалентной связи может происходить и по донорно-акцепторному механизму. В этом случае химическая связь возникает за счёт двухэлектронного облака одного атома (спаренных электронов) и свободной орбитали другого атома. Атом, предоставляющий неподеленную пару, называется донором, а атом, принимающий её (т. е. предоставляющий свободную орбиталь) – акцептором.
Механизм образования ковалентной связи за счёт двухэлектронного облака одного атома (донора) и свободной орбитали другого атома (акцептора) называется донорно-акцепторным; образованная таким путём ковалентная связь называется донорно-акцепторной иликоординационной связью.
Рассмотрим в качестве примера механизм образования иона $$ {mathrm{NH}}^{4 }$$. В молекуле аммиака атом азота имеет неподеленную пару электронов; у иона водорода свободна `1s`-орбиталь. При образовании катиона аммония двухэлектронное облако азота становится общим для атомов $$ mathrm{N}$$ и $$ mathrm{H}$$, т. е. оно превращается в молекулярное электронное облако. Таким образом, возникает четвертая ковалентная связь:
Положительный заряд иона водорода становится общим (он рассредоточен между всеми атомами), а двухэлектронное облако (неподеленная электронная пара), принадлежавшее азоту, становится общим с водородом. По своим свойствам четвертая $$ mathrm{N}-mathrm{H}$$ связь в ионе $$ {mathrm{NH}}_{4}^{ }$$ ничем не отличается от остальных трех. Поэтому донорно-акцепторная связь – это не особый вид связи, а лишь особый механизм (способ) образования ковалентной связи.
Еще один тип связи – ионная связь – возникает, когда взаимодействуют электронные облака атомов, чьи относительные электроотрицательности резко отличаются. В этом случае общая электронная пара настолько смещена к одному из атомов, что практически переходит в его владение. При этом он образует отрицательно заряженный анион, а атом, отдавший электрон – катион. Например, атомы натрия и хлора резко отличаются по электроотрицательности (`x=0,9` и `x=3` соответственно), поэтому атом хлора очень сильно притягивает электрон, стремясь завершить свой внешний электронный уровень, а атом натрия охотно его отдаёт, поскольку ему для получения устойчивой конфигурации внешнего слоя удобнее отдать единственный валентный электрон:
$$ mathrm{Na}left(1{s}^{2}2{s}^{2}2{p}^{6}3{s}^{1}right)–е={mathrm{Na}}^{ }left(1{s}^{2}2{s}^{2}2{p}^{6}right)$$
$$ mathrm{Cl}left(1{s}^{2}2{s}^{2}2{p}^{6}3{s}^{2}3{p}^{5}right) е={mathrm{Cl}}^{-}left(1{s}^{2}2{s}^{2}2{p}^{6}3{s}^{2}3{p}^{6}right)$$.
Электронная оболочка атома натрия превратилась в устойчивую оболочку атома неона, а оболочка хлора – в устойчивую оболочку другого инертного газа – аргона. Между ионами $$ {mathrm{Na}}^{ }$$ и $$ {mathrm{Cl}}^{-}$$, несущими разноименные заряды, возникают силы электростатического притяжения, в результате чего образуется соединение $$ mathrm{NaCl}$$.
Химическая связь между ионами, возникающая в результате их электростатического притяжения,называетсяионной связью.
Ионные соединения образуют атомы элементов, резко отличающихся по электроотрицательности, например атомы элементов главных подгрупп $$ mathrm{I}$$ и $$ mathrm{II}$$ и групп с элементами главных подгрупп $$ mathrm{VI}$$ и $$ mathrm{VII}$$ групп.
Таким образом, между механизмами возникновения ковалентной и ионной связей нет принципиального различия. Они различаются лишь степенью поляризации (смещения) общих электронных пар. Поэтому можно рассматривать ионную связь как предельный случай полярной ковалентной связи.
Вместе с тем надо помнить о важных отличиях ионной связи от ковалентной. Ионная связь характеризуется ненаправленностью в пространстве (каждый ион может притягивать ион противоположного знака по любому направлению) и ненасыщаемостью (взаимодействие ионов не устраняет способность притягивать или отталкивать другие ионы). Вследствие ненаправленности и ненасыщаемости ионные соединения в твёрдом состоянии представляют собой ионную кристаллическую решётку, в которой каждый ион взаимодействует не с одним, а со многими ионами противоположного знака; например, в решётке хлорида натрия катион натрия окружён шестью хлорид-анионами и наоборот. Связи между ионами многочисленны и прочны, поэтому вещества с ионной решёткой тугоплавки, малолетучи и обладают сравнительно высокой твёрдостью. При плавлении ионных кристаллов прочность связи между ионами уменьшается, и расплавы их проводят электрический ток. Ионные соединения, как правило, хорошо растворяются в воде и других полярных растворителях.
В то же время ковалентная связь отличается насыщаемостью (т. е. способностью атомов образовывать ограниченное количество ковалентных связей, определяемое числом неспаренных электронов) и направленностью (определённой пространственной структурой молекул, которой мы коснёмся ниже).
Твёрдые вещества, состоящие из молекул (полярных и неполярных), образуют молекулярные кристаллические решётки. Молекулы в таких решётках соединены сравнительно слабыми межмолекулярными силами, поэтому вещества с молекулярной решёткой имеют малую твёрдость, низкие температуры плавления, они плохо растворимы в воде, а их растворы почти не проводят электрический ток. Число неорганических веществ с молекулярной кристаллической решёткой невелико: лёд, твёрдый оксид углерода `(“IV”)` («сухой лёд»), твёрдые галогеноводороды и простые вещества, но зато большинство кристаллических органических соединений имеют молекулярную решётку.
Если же в узлах решётки располагаются атомы, соединённые прочными ковалентными связями, то такие вещества имеют высокие температуры плавления, прочность и твёрдость, они практически нерастворимы в жидкостях.
Характерный пример вещества с атомной кристаллической решёткой – алмаз; она характерна также для твёрдого бора, кремния, германия и соединений некоторых элементов с углеродом и кремнием.
Особый тип решётки в твёрдом состоянии образуют металлы. В узлах такой металлической кристаллической решётки находятся катионы металлов, а между ними – отрицательно заряженный «электронный газ». Атомы металлов в решётке упакованы так тесно, что валентные орбитали соседних атомов перекрываются, и электроны получают возможность свободно перемещаться из орбиталей одного атома в орбитали других атомов, осуществляя связь между всеми атомами данного кристалла металла. Лишённые валентных электронов, атомы превращаются в катионы, а электроны, осуществляющие связь, перемещаются по всему кристаллу металла и становятся общими.
Такой тип химической связи, которая осуществляется электронами, принадлежащими всем атомам одновременно, называется металлической связью.Металлическая связь характерна для металлов в твёрдом и жидком состоянии.
Металлическая связь имеет некоторое сходство с ковалентной, поскольку и в ее основе лежит обобществление валентных электронов. Однако при ковалентной связи эти электроны находятся вблизи соединенных атомов и прочно с ними связаны, тогда как при металлической связи электроны свободно перемещаются по всему кристаллу и принадлежат всем его атомам. Именно поэтому кристаллы с ковалентной связью хрупки, а с металлической – пластичны, т. е. без разрушения изменяют форму, прокатываются в листы, вытягиваются в проволоку. Наличие свободных электронов придает кристаллам металлов непрозрачность, высокую электрическую проводимость, теплопроводность.
Иногда в соединениях мы встречаемся с особой формой химической связи – так называемой водородной связью. Она менее прочна, чем уже рассмотренные виды, и может считаться дополнительной связью к уже существующим ковалентным.
Водородная связь возникает между атомом водорода в соединении и сильно электроотрицательным элементом с малыми размерами – фтором, кислородом, азотом, реже хлором и серой.
Водородную связь обозначают точками, подчёркивая тем самым её сравнительную слабость (примерно в $$ 15–20$$ раз слабее ковалентной).
Водородная связь весьма распространена и играет важную роль при ассоциации молекул, в процессах кристаллизации, растворения, образования кристаллогидратов, электролитической диссоциации и других важных физико-химических процессах.
Молекула воды может образовывать четыре водородные связи, так как имеет два атома водорода и две несвязывающие электронные пары:
Эта способность обусловливает строение и свойства воды и льда.
Вода является жидкостью, хотя более тяжелый сероводород – полный электронный аналог воды – газ. Молекулы воды образуют между собой водородные связи, что увеличивает плотность вещества в жидком состоянии и его температуру кипения. Между молекулами сероводорода подобных связей не возникает из-за большого радиуса и сравнительно малой электро-отрицательности атома серы.
При замерзании количество водородных связей между молекулами воды становится максимальным. Строго ориентируясь относительно друг друга, они образуют правильные шестиугольники. Образованные ими канальцы заполнены воздухом, поэтому плотность льда меньше плотности воды (рис. 7).
Водородная связь приводит к образованию димеров муравьиной и уксусной кислот, устойчивых в газообразном и жидком состоянии:
Благодаря водородной связи фтороводород `”HF”` в обычных условиях суще-ствует в жидком состоянии (`”t”_”кип”=19,5^@”C”`), а плавиковая кислота диссоциирует с образованием как фторид-аниона `”F”^−`, так и гидродифторид-аниона $$ {mathrm{HF}}_{2}^{-}$$.
Важную роль играют водородные связи в химии процессов жизнедеятельности, поскольку они распространены в молекулах белков, нуклеиновых кислот и других биологически важных соединений.
Водородная связь
Химическую связь между положительно поляризованными атомами водорода одной молекулы (или ее части) и отрицательно поляризованными атомами сильно электроотрицательных элементов, имеющих неподеленные электронные пары ($F, O, N$ и реже $S$ и $Cl$), другой молекулы (или ее части) называют водородной.
Механизм образования водородной связи имеет частично электростатический, частично донорно- акцепторный характер.
Примеры межмолекулярной водородной связи:
При наличии такой связи даже низкомолекулярные вещества могут быть при обычных условиях жидкостями (спирт, вода) или легко сжижающимися газами (аммиак, фтороводород).
Вещества с водородной связью имеют молекулярные кристаллические решетки.
Вопросы для самопроверки
Дайте определение ковалентной связи.
Что такое ковалентная полярная связь, чем она отличается от неполярной?
Исключите лишнее: ковалентная полярная связь характерна для H2S, O2, N2O5, SF6.
Чем обусловлена кратность химической связи?
Назовите два механизма образования ковалентной связи.
Ионы. ионная связь
Представим себе, что «встречаются» два атома: атом металла I группы и атом неметалла VII группы. У атома металла на внешнем энергетическом уровне находится единственный электрон, а атому неметалла как раз не хватает именно одного электрона, чтобы его внешний уровень оказался завершенным.
Первый атом легко отдаст второму свой далекий от ядра и слабо связанный с ним электрон, а второй предоставит ему свободное место на своем внешнем электронном уровне.
Тогда атом, лишенный одного своего отрицательного заряда, станет положительно заряженной частицей, а второй превратится в отрицательно заряженную частицу благодаря полученному электрону. Такие частицы называются ионами.
Химическая связь, возникающая между ионами, называется ионной.
Рассмотрим образование этой связи на примере хорошо всем знакомого соединения хлорида натрия (поваренная соль):
Процесс превращения атомов в ионы изображен на схеме:
Такое превращение атомов в ионы происходит всегда при взаимодействии атомов типичных металлов и типичных неметаллов.
Рассмотрим алгоритм (последовательность) рассуждений при записи образования ионной связи, например между атомами кальция и хлора:
- Кальций — это элемент главной подгруппы II группы, металл. Его атому легче отдать два внешних электрона, чем принять недостающие шесть:${Ca^0}↙{атом}-2e↖{-}→Ca^{2 }↙{ион}$.
- Хлор — это элемент главной подгруппы VII группы, неметалл. Его атому легче принять один электрон, которого ему не хватает до завершения внешнего уровня, чем отдать семь электронов с внешнего уровня:${Cl^0}↙{атом} 1e↖{-}→Cl^{-}↙{ион}$.
- Сначала найдем наименьшее общее кратное между зарядами образовавшихся ионов, оно равно $2 (2 · 1)$. Затем определим, сколько атомов кальция нужно взять, чтобы они отдали два электрона, т.е. надо взять один атом $Са$, и сколько атомов хлора надо взять, чтобы они могли принять два электрона, т.е. нужно взять два атома $Cl$.
- Схематично образование ионной связи между атомами кальция и хлора можно записать так:
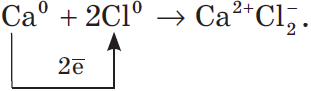
Цифры, показывающие число атомов или молекул, называются коэффициентами, а цифры, показывающие число атомов или ионов в молекуле, называют индексами.
Ковалентная химическая связь, ее разновидности и механизмы образования. характеристика ковалентной связи (полярность и энергия связи). ионная связь. металлическая связь. водородная связь
Учение о химической связи составляет основу всей теоретической химии.
Под химической связью понимают такое взаимодействие атомов, которое связывает их в молекулы, ионы, радикалы, кристаллы.
Различают четыре типа химических связей: ионную, ковалентную, металлическую и водородную.
Деление химических связей на типы носит условный характер, по скольку все они характеризуются определенным единством.
Ионную связь можно рассматривать как предельный случай ковалентной полярной связи.
Металлическая связь совмещает ковалентное взаимодействие атомов с помощью обобществленных электронов и электростатическое притяжение между этими электронами и ионами металлов.
В веществах часто отсутствуют предельные случаи химической связи (или чистые химические связи).
Например, фторид лития $LiF$ относят к ионным соединениям. Фактически же в нем связь на $80%$ ионная и на $20%$ ковалентная. Правильнее поэтому, очевидно, говорить о степени полярности (ионности) химической связи.
В ряду галогеноводородов $HF—HCl—HBr—HI—HАt$ степень полярности связи уменьшается, ибо уменьшается разность в значениях электроотрицательности атомов галогена и водорода, и в астатоводороде связь становится почти неполярной $(ЭО(Н) = 2.1; ЭО(At) = 2.2)$.
Различные типы связей могут содержаться в одних и тех же веществах, например:
- в основаниях: между атомами кислорода и водорода в гидроксогруппах связь полярная ковалентная, а между металлом и гидроксогруппой — ионная;
- в солях кислородсодержащих кислот: между атомом неметалла и кислородом кислотного остатка — ковалентная полярная, а между металлом и кислотным остатком — ионная;
- в солях аммония, метиламмония и т. д.: между атомами азота и водорода — ковалентная полярная, а между ионами аммония или метиламмония и кислотным остатком — ионная;
- в пероксидах металлов (например, $Na_2O_2$) связь между атомами кислорода ковалентная неполярная, а между металлом и кислородом — ионная и т.д.
Различные типы связей могут переходить одна в другую:
— при электролитической диссоциации в воде ковалентных соединений ковалентная полярная связь переходит в ионную;
— при испарении металлов металлическая связь превращается в ковалентную неполярную и т.д.
Причиной единства всех типов и видов химических связей служит их одинаковая химическая природа — электронно-ядерное взаимодействие. Образование химической связи в любом случае представляет собой результат электронно-ядерного взаимодействия атомов, сопровождающегося выделением энергии.
Кристаллические решетки
Вещество, как известно, может существовать в трех агрегатных состояниях: газообразном, жидком и твердом.
Твердые вещества: аморфные и кристаллические.
Рассмотрим, как влияют особенности химических связей на свойства твердых веществ. Твердые вещества делятся на кристаллические и аморфные.
Аморфные вещества не имеют четкой температуры плавления — при нагревании они постепенно размягчаются и переходят в текучее состояние. В аморфном состоянии, например, находятся пластилин и различные смолы.
Кристаллические вещества характеризуются правильным расположением тех частиц, из которых они состоят: атомов, молекул и ионов — в строго определенных точках пространства. При соединении этих точек прямыми линиями образуется пространственный каркас, называемый кристаллической решеткой. Точки, в которых размещены частицы кристалла, называют узлами решетки.
В зависимости от типа частиц, расположенных в узлах кристаллической решетки, и характера связи между ними различают четыре типа кристаллических решеток: ионные, атомные, молекулярные и металлические.
Ионные кристаллические решетки.
Ионными называют кристаллические решетки, в узлах которых находятся ионы. Их образуют вещества с ионной связью, которой могут быть связаны как простые ионы $Na^{ }, Cl^{–}$, так и сложные $SO_4^{2−}, ОН^–$. Следовательно, ионными кристаллическими решетками обладают соли, некоторые оксиды и гидроксиды металлов.
Например, кристалл хлорида натрия состоит из чередующихся положительных ионов $Na^ $ и отрицательных $Cl^–$, образующих решетку в форме куба. Связи между ионами в таком кристалле очень устойчивы. Поэтому вещества с ионной решеткой отличаются сравнительно высокой твердостью и прочностью, они тугоплавки и нелетучи.
Атомные кристаллические решетки.
Атомными называют кристаллические решетки, в узлах которых находятся отдельные атомы. В таких решетках атомы соединены между собой очень прочными ковалентными связями. Примером веществ с таким типом кристаллических решеток может служить алмаз — одно из аллотропных видоизменений углерода.
Большинство веществ с атомной кристаллической решеткой имеют очень высокие температуры плавления (например, у алмаза она выше $3500°С$), они прочны и тверды, практически нерастворимы.
Молекулярные кристаллические решетки.
Молекулярными называют кристаллические решетки, в узлах которых располагаются молекулы. Химические связи в этих молекулах могут быть и полярными ($HCl, H_2O$), и неполярными ($N_2, O_2$). Несмотря на то, что атомы внутри молекул связаны очень прочными ковалентными связями, между самими молекулами действуют слабые силы межмолекулярного притяжения.
Металлические кристаллические решетки.
Вещества с металлической связью имеют металлические кристаллические решетки. В узлах таких решеток находятся атомы и ионы (то атомы, то ионы, в которые легко превращаются атомы металла, отдавая свои внешние электроны «в общее пользование»). Такое внутреннее строение металлов определяет их характерные физические свойства: ковкость, пластичность, электро- и теплопроводность, характерный металлический блеск.
Металлическая связь
Ознакомимся с тем, как взаимодействуют между собой атомы элементов-металлов. Металлы обычно существуют не в виде изолированных атомов, а в форме куска, слитка или металлического изделия. Что удерживает атомы металла в едином объеме?
Атомы большинства металлов на внешнем уровне содержат небольшое число электронов — $1, 2, 3$. Эти электроны легко отрываются, и атомы при этом превращаются в положительные ионы. Оторвавшиеся электроны перемещаются от одного иона к другому, связывая их в единое целое.
Связь в металлах между ионами посредством обобществленных электронов называется металлической.
На рисунке схематически изображено строение фрагмента металла натрия.
При этом небольшое число обобществленных электронов связывает большое число ионов и атомов.
Металлическая связь имеет некоторое сходство с ковалентной, поскольку основана на обобществлении внеш них электронов. Однако при ковалентной связи обобществлены внешние непарные электроны только двух соседних атомов, в то время как при металлической связи в обобществлении этих электронов принимают участие все атомы.
Металлическая связь характерна как для чистых металлов, так и для смесей различных металлов — сплавов, находящихся в твердом и жидком состояниях.
Молекулярное и немолекулярное строение веществ
В химические взаимодействия вступают не отдельные атомы или молекулы, а вещества. Вещество при заданных условиях может находиться в одном из трех агрегатных состояний: твердом, жидком или газообразном. Свойства вещества зависят также от характера химической связи между образующими его частицами — молекулами, атомами или ионами. По типу связи различают вещества молекулярного и немолекулярного строения.
Вещества, состоящие из молекул, называются молекулярными веществами. Связи между молекулами в таких веществах очень слабые, намного слабее, чем между атомами внутри молекулы, и уже при сравнительно низких температурах они разрываются — вещество превращается в жидкость и далее в газ (возгонка йода). Температуры плавления и кипения веществ, состоящих из молекул, повышаются с увеличением молекулярной массы.
К молекулярным веществам относятся вещества с атомной структурой ($C, Si, Li, Na, K, Cu, Fe, W$), среди них есть металлы и неметаллы.
Рассмотрим физические свойства щелочных металлов. Относительно малая прочность связи между атомами обуславливает низкую механическую прочность: щелочные металлы мягкие, легко режутся ножом.
Большие размеры атомов приводят к малой плотности щелочных металлов: литий, натрий и калий даже легче воды. В группе щелочных металлов температуры кипения и плавления понижаются с увеличением порядкового номера элемента, т.к. размеры атомов увеличиваются, и ослабевают связи.
К веществам немолекулярного строения относятся ионные соединения. Таким строением обладает большинство соединений металлов с неметаллами: все соли ($NaCl, K_2SO_4$), некоторые гидриды ($LiH$) и оксиды ($CaO, MgO, FeO$), основания ($NaOH, KOH$). Ионные (немолекулярные) вещества имеют высокие температуры плавления и кипения.
Направленность ковалентной связи
Ковалентная связь становится направленной, если в ней участвуют атомы, чьи орбитали (электронные облака) находятся под определенным углом друг к другу. Если провести воображаемые линии между связанными атомами, можно увидеть этот угол — он называется валентным. По значениям валентных углов легко определить строение молекулы вещества, ее геометрическую форму.
В зависимости от взаимного расположения орбиталей выделяют:
σ-связи, которые образуются, если перекрывание орбиталей идет по оси, соединяющей ядра атомов (т. е. линейно);
π-связи, которые предполагают боковое перекрывание (электронные облака находятся под углом друг к другу).
Как понятно из этих определений, два атома могут иметь только одну σ-связь, а в дополнение к этому они могут быть связаны с другими атомами π-связями.
Насыщаемость ковалентной связи
Насыщаемость говорит об ограничениях по количеству взаимодействий, в которые может вступать один атом. Таких взаимодействий, т. е. химических связей, может быть ровно столько, сколько у атома неспаренных электронов. Как мы помним из примеров выше, у водорода один валентный электрон, поэтому он может образовать только одинарную ковалентную связь.
Важно!
Количество свободных электронов может увеличиться, если атом перейдет в возбужденное состояние. В этом случае происходит распаривание электронов и перемещение их на свободные орбитали более высоких подуровней внешнего уровня. Эти распаренные электроны также способны вступать в химические связи.
Характеристики ковалентной связи
К ковалентным связям применимы те же общие закономерности, что и для других типов. Например, чем меньше длина ковалентной связи, тем она прочнее. Но есть и специфические свойства, которые появляются только при этом виде взаимодействия:
насыщаемость,
полярность,
направленность.



